| 成分・含量 | 1錠中 タダラフィル10mg |
| 添加物 | 乳糖水和物,結晶セルロース,ヒドロキシプロピルセルロース,クロスカルメロースナトリウム,ラウリル硫酸ナトリウム,ステアリン酸マグネシウム,ヒプロメロース,タルク,マクロゴール6000,酸化チタン,リボフラビン |
| 成分・含量 | 1錠中 タダラフィル20mg |
| 添加物 | 乳糖水和物,結晶セルロース,ヒドロキシプロピルセルロース,クロスカルメロースナトリウム,ラウリル硫酸ナトリウム,ステアリン酸マグネシウム,ヒプロメロース,タルク,マクロゴール6000,酸化チタン,リボフラビン |
| 貯法 | 室温保存 |
| 使用期限 | 外箱等に表示 |
処方箋医薬品
注意−医師等の処方箋により使用すること
タダラフィル錠
警告1. 本剤と硝酸剤又は一酸化窒素(NO)供与剤(ニトログリセリン,亜硝酸アミル,硝酸イソソルビド等)との併用により降圧作用が増強し,過度に血圧を下降させることがあるので,本剤投与の前に,硝酸剤又は一酸化窒素(NO)供与剤が投与されていないことを十分確認し,本剤投与中及び投与後においても硝酸剤又は一酸化窒素(NO)供与剤が投与されないよう十分注意すること.(「禁忌」の項参照) |
禁忌(次の患者には投与しないこと) |
| 外形(表) | 外形(側面) | 外形(裏) |
|
|
|
|
| 直径 | 厚さ | 重量 |
| 約7.1mm | 約3.0mm | 約125mg |
黄色のフィルムコーティング錠 20mgCI
| 外形(表) | 外形(側面) |
|
 |
 |
| 直径 |
|
重量 |
| 約9.1mm |
|
|
勃起不全
(満足な性行為を行うに十分な勃起とその維持が出来ない患者)
(次の患者には慎重に投与すること)
(併用に注意すること)
CYP3A4阻害剤(ケトコナゾール,イトラコナゾール,クラリスロマイシン,テラプレビル,グレープフルーツジュース 等)
カルペリチド
併用禁忌(併用しないこと)
|
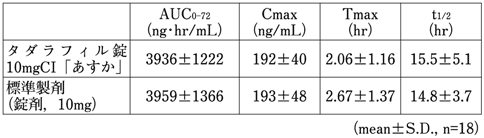
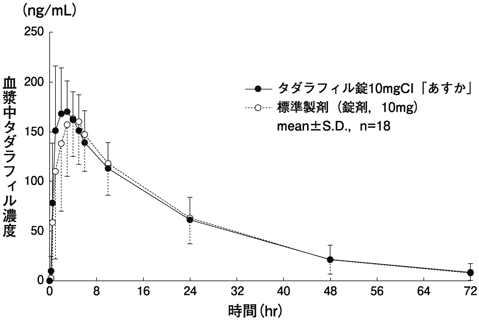
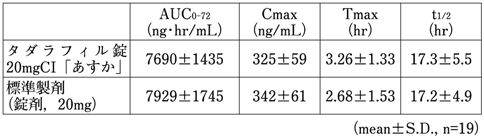
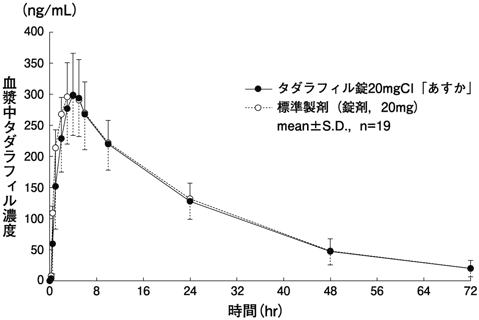
1) 社内資料(生物学的同等性試験)
2) グッドマン・ギルマン薬理書(下)薬物治療の基礎と臨床 第12版,廣川書店,2330,2013
3) 社内資料(安定性試験)
主要文献に記載の社内資料につきましても下記にご請求ください.
あすか製薬株式会社 くすり相談室
〒108-8532 東京都港区芝浦二丁目5番1号
TEL 0120-848-339
FAX 03-5484-8358
製造販売元
大興製薬株式会社
埼玉県川越市下赤坂560番地1
発売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号